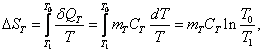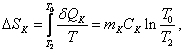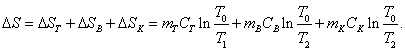|
Лабораторная работа № 210 ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ РЕАЛЬНЫХ СИСТЕМ Цель работы: на основании II
закона термодинамики, используя экспериментальные данные, определить
изменение энтропии реальных тел. Приборы и принадлежности: калориметрический
стакан, термометр,
нагреватель,
набор
различных тел, мерный
стакан. 1. ЗАКОНЫ ТЕРМОДИНАМИКИ Термодинамика – наука о
наиболее общих тепловых свойствах макроскопических тел. Термодинамика изучает
процессы превращения энергии из одного вида в другой и характеризует эти
превращения с количественной стороны. Она занимается изучением различных
свойств тел и изменений состояния вещества на макроскопическом уровне. В основе термодинамики
лежат три фундаментальных закона (три начала термодинамики), установленных на
основании обобщения большой совокупности опытных данных. Мы в этой работе
ограничимся рассмотрением только двух законов термодинамики. I закон
термодинамики выражает всеобщий закон сохранения и превращения энергии и
гласит, что количество теплоты,
сообщаемое термодинамической системе, расходуется на увеличение внутренней
энергии и на совершение системой работы против внешних сил.
Математическая запись I закона термодинамики: где dU –
бесконечно малое изменение внутренней энергии системы; dQ, dA – соответственно, бесконечно малая теплота,
подводимая к системе и элементарная работа. Термодинамической системой называется совокупность макроскопических
объектов (тел), обменивающихся энергией и веществом друг с другом и с внешней средой. Состояние
термодинамической системы
характеризуется температурой Т,
давлением Р, объемом V, массой m и другими величинами,
которые называются термодинамическими
параметрами. Термодинамические системы, которые не обмениваются с внешней
средой ни энергией, ни веществом, называются изолированными (замкнутыми). Всякое изменение
состояния термодинамической системы, связанное с изменением ее параметров
состояния, называется термодинамическим
процессом. I закон термодинамики не позволяет определить
направление протекания термодинамических процессов в природе. Например, если
происходит теплообмен между телами различной температуры, то закон сохранения
энергии требует только, чтобы количество теплоты, отданное одним телом,
равнялось количеству теплоты, полученному другим. То есть ответить на вопрос,
в каком направлении происходит переход теплоты, первый закон термодинамики не может. Первому закону
термодинамики не противоречит самопроизвольный процесс перехода теплоты от
тела менее нагретого к телу более нагретому. В природе самопроизвольный процесс перехода теплоты происходит только
от тела более нагретого к телу менее нагретому. I закон термодинамики не
может дать ответ на вопрос, возможен ли в тепловой машине полный переход
теплоты в работу? Из опыта известно, что работа полностью может перейти в
теплоту, а обратный процесс возможен только при Т = const. Как показал Карно, превращение теплоты в работу подвержено
ограничению: необходимым условием такого превращения является разность
температур, и чем она больше, тем большая доля теплоты может превратиться в
работу. Тепловые машины дают возможность превращать теплоту в работу,
однако не в эквивалентных количествах,
поскольку КПД машин всегда меньше единицы. Поэтому теплота, которая берется
от нагревателя, больше теплоты, превращаемой в работу, и часть ее отдается
холодильнику. Можно привести и другие примеры. Ответы на выше
поставленные вопросы дает II закон термодинамики.
Существует несколько формулировок II закона термодинамики,
отличающихся по форме, но одинаковых по существу. Согласно Карно: «Теплота не может самопроизвольно перейти
от холодного тела к горячему». По Клаузиусу: «Невозможны такие процессы, единственным
результатом которых был бы переход теплоты от тела менее нагретого к телу
более нагретому». Для такого перехода
теплоты требуется затрата работы от внешнего источника. Физический смысл II закона
термодинамики наиболее ясно раскрывается в формулировке Томсона и Планка: «Невозможен такой периодический процесс,
единственным результатом которого было бы превращение теплоты, полученной от
нагревателя, в эквивалентную ей работу». Возможным является такой
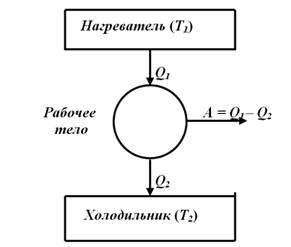
периодический процесс, при котором часть теплоты Q1, полученной рабочим телом
от нагревателя, превращается в работу, а другая часть теплоты Q2 не используется и передается холодильнику с
температурой Т2<T1 (рис. 1). Таким образом, в любой
тепловой машине превращается в работу только часть полученной от нагревателя
теплоты: А = Q1 -
Q2. Формулировка второго закона термодинамики по Оствальду: «Невозможно осуществить вечный двигатель
второго рода, т.е. такой периодически действующий двигатель, который получал
бы тепло от одного резервуара энергии и полностью превращал это тепло в работу».
Рис. 1. Итак, из
вышеперечисленных формулировок видно, что II закон термодинамики
указывает направление самопроизвольных термодинамических процессов и налагает
ограничение на возможность превращения тепла в работу. Круговые процессы (циклы), при
протекании которых в окружающей среде остаются какие-либо изменения,
называются необратимыми. Необратимые процессы могут самопроизвольно
протекать только в одном направлении. Например, необратимыми являются:
переход тепла от нагретого тела к холодному, диффузия, расширение газа в
пустоту, выравнивание температуры и т.д. Практически все явления природы
являются необратимыми из-за наличия диссипативных сил, диффузии и др. В природе любая
изолированная система через достаточно длительный промежуток времени
переходит в равновесное состояние. Если при постоянных внешних условиях
параметры состояния термодинамической системы во всех ее частях при
одинаковой температуре не меняются со временем, а также отсутствуют потоки
энергии, импульса, массы вещества, то такое состояние называется равновесным. В равновесном состоянии
изолированная система может находиться сколь угодно долго и сама по себе не
может выйти из этого состояния. Обратимым процессом называется такой процесс, в результате которого
вся система возвращается в первоначальное состояние без каких-либо изменений
в окружающей среде. Примером обратимых процессов являются все механические процессы, если
в них нет превращения механической энергии в другие виды энергии
(электромагнитную, тепловую и т.д.), т.е. если отсутствуют диссипативные
силы. На практике обратимый
процесс неосуществим, он является абстракцией реального процесса. Хотя в
природе не существуют обратимые процессы, однако их изучение дает возможность
понять основные термодинамические свойства реальных систем. В современной
термодинамике для формулировки второго закона термодинамики используется
понятие энтропии S,
введенное Клаузиусом. Как известно, при
сохранении внутренней энергии в изолированной термодинамической системе,
казалось бы, возможны любые процессы. На самом деле не совсем так. Дело в
том, что различные состояния, отвечающие одной и той же энергии, обладают
разной вероятностью. Изолированная система будет самопроизвольно переходить
из менее вероятных в более вероятные состояния, либо длительное время будет
находиться в равновесном (более вероятном) состоянии. Рассмотрим пример. Пусть
изолированная система состоит из двух тел с различной температурой в
начальный момент времени. В ней будет протекать процесс теплопередачи,
приводящий к выравниванию температуры. После того, как температура обоих тел
станет одинаковой, система будет оставаться в таком состоянии неограниченно
долго. Поэтому в изолированной системе невозможен процесс, в результате
которого температура одного из одинаково нагретых тел стала бы больше или
меньше другого. Можно привести другой
пример: процесс распространения газа на весь сосуд. Обратный процесс, в
результате которого газ самопроизвольно собрался бы в одной из половин
сосуда, невозможен. Из сказанного выше
следует, что для того чтобы определить, какие процессы могут протекать в
изолированной системе, нужно знать вероятность различных состояний этой
системы. Величина, характеризующая вероятность состояний, получила название
энтропии. Энтропия – функция состояния системы, изменение которой характеризует
направление протекания самопроизвольных процессов. Функцией состояния
называется такая физическая характеристика системы, изменение которой при
переходе системы из одного состояния в другое не зависит от вида
соответствующего этому переходу термодинамического процесса, а целиком
определяется значениями параметров начального и конечного состояний. Как всякая функция
состояния, энтропия определяется только параметрами состояния и не зависит от
процесса, с помощью которого система пришла в это состояние: S = S(T,V), S = S(P,V), (2) S = S(T,P). Бесконечно малое
изменение энтропии системы определяется формулой: где dQ – бесконечно
малое количество тепла, сообщаемое системе при бесконечно малом изменении ее
состояния; Т – абсолютная
температура, при которой тепло поглощается системой. Отметим то
обстоятельство, что dQ не является полным дифференциалом и не является изменением количества
тепла. Если система переходит из
состояния 1 в состояние 2, то изменение энтропии равно: где S1, S2 – энтропия начального и
конечного состояния системы. При обратимом процессе,
если система приходит в первоначальное состояние, то изменение энтропии равно
нулю: т.е. энтропия изолированной системы при обратимом
процессе остается постоянной (S =const). Если система совершает
необратимый процесс, то изменение энтропии определяется неравенством Причем, из (6) следует,
что если система изолирована, то Неравенство (7),
называемое неравенством Клаузиуса, утверждает следующее: «В изолированной
системе, где протекают необратимые процессы, энтропия системы всегда
возрастает» (закон возрастания энтропии). Объединяя соотношения (5) и (7),
можно записать: Соотношение (8) выражает
математическую формулировку второго закона термодинамики: «Энтропия изолированной системы либо
возрастает (при необратимом
процессе), либо остается постоянной
(при обратимом процессе)». Таким образом, изменение
энтропии характеризует направление протекания естественных процессов в
замкнутой системе: естественные
процессы проходят в направлении роста энтропии. Опыт показывает, что
замкнутая система, предоставленная самой себе, через некоторое время
переходит в равновесное состояние, из которого без внешних воздействий не
может выйти. В таких самопроизвольных процессах, как расширение газа,
смешение двух газов и т.д., увеличение энтропии сопровождается увеличением
степени неупорядоченности системы. Л.Больцман (1896 г.)
ответил на вопрос о физическом смысле энтропии. Согласно Больцману: энтропия – мера беспорядка в системе.
Полный порядок соответствует минимуму энтропии, беспорядок - максимуму энтропии. Больцман ввел понятие
термодинамической вероятности W.
Термодинамическая вероятность –
это число способов, с помощью которых
можно осуществить данное состояние макросистемы, или число микросостояний,
осуществляющих данное макросостояние. Макросостояние характеризуется
термодинамическими параметрами системы P, V, T, m и др., которые характеризуют систему в целом.
Микросостояния - различные способы
размещения частиц, из которых состоит система. Энтропия и
термодинамическая вероятность связаны функцией: где k
– постоянная Больцмана. Связь энтропии и
термодинамической вероятности позволяет вскрыть статистический смысл второго
закона термодинамики: всякий процесс в
природе протекает в сторону увеличения вероятности состояния системы. Например, разделенные
газы до смешения можно считать более упорядоченными (менее вероятными), чем
смешанные газы (неупорядоченные). Второе состояние более вероятное.
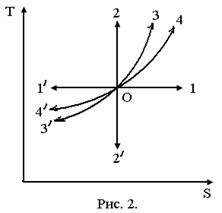
На рисунке 2 приведена TS-диаграмма
для идеального газа. Пусть точка О на TS-диаграмме изображает
начальное состояние идеального газа. Прямая 1/-1, проходящая через точку О параллельно
оси абсцисс, соответствует изотермическому процессу: 0 ®1 - изотермическое
расширение (теплота подводится, так что dS > 0), 0 ®1/ - изотермическое сжатие (теплота отводится - dS < 0). Прямая 2/-2 изображает адиабатный (изоэнтропийный S = const) процесс: 0 ®2 - адиабатное сжатие (dT > 0) и 0 ®2/ - адиабатное расширение (dT < 0). Кривая 3/-3 изображает изохорный процесс: 0 ®3 - изохорное нагревание (dS > 0 и dT > 0), 0 ®3/ - изохорное охлаждение (dS < 0 и dT < 0). Для изобарного
процесса соответствует кривая 4/-4: 0 ®4 - изобарное расширение (dS > 0 и dT > 0), 0 ®4/ - изобарное сжатие (dS < 0 и dT < 0).
1.
ОПИСАНИЕ РАБОЧЕЙ
УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ В работе используется
система, состоящая из калориметрического стакана с водой и металлического
тела. На электроплитку (1)
помещают стакан с водой (2), которую доводят до кипения. В
кипящую воду опускается исследуемое тело (3). Через 3–5 мин оно нагревается до температуры Т1. Измерение температуры
воды в стакане производится с помощью термометра (4) (см. рис. 4). Нагретое до температуры Т1 тело (3)
с помощью нитки, прикрепленной к нему, быстро вносится в калориметрический
стакан (5) с водой при комнатной температуре Т2 и закрывается крышкой (6). После того, как
тело внесено в калориметр, систему «калориметр – тело – вода» можно считать
изолированной, и пока температуры тела, калориметра и воды не выровняются,
система находится в неравновесном состоянии. Через некоторое время она
приходит в равновесное состояние.
Обозначим через Т0 температуру всех тел
системы в равновесном состоянии. При этом тело (3) охлаждается до температуры Т0,
отдавая некоторое количество теплоты системе «вода - калориметрический стакан», которые нагреваются до некоторой температуры Т0. Элементарное количество
теплоты, отданное системе «вода - калориметрический
стакан» нагретым телом (3) определяется соотношением: где Изменение энтропии тела где Элементарное количество
теплоты, полученное водой и калориметрическим стаканом, равно: и где Изменения энтропии воды
где Тогда
общее изменение энтропии
Измерив температуры Т1, Т2 и Т0
и, зная массы и теплоемкости всех частей системы, можно определить изменение
энтропии системы при ее переходе от неравновесного состояния к равновесному.
В данной работе не учтена потеря количества тепла при переносе нагретых тел
из стакана с кипящей водой (2) в калориметрический стакан (5),
а также теплообмен с окружающей средой, которые существенно влияют на
результаты эксперимента. 3.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
И ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ 1. Включите электроплитку (1)
и поставьте на нее стакан (2) с
водой.
3. Воду в стакане (2)
нужно довести до кипения и измерить температуру Т1 кипящей
воды с помощью термометра (4). 4. Пока вода вместе с
исследуемым телом (3) нагреваются, отмерьте с помощью
мерного стакана 150 мл холодной
воды, налейте ее в калориметрический
стакан (5) и поставьте его подальше
от плитки. 5. Измерьте температуру Т2 холодной воды в калориметрическом стакане с помощью термометра.
При этом температура калориметрического стакана (5) равна температуре
воды. 6. Запишите в таблицу 1
массу металлического тела mT, массу холодной воды mВ, массу
калориметрического стакана mК и температуры Т1 и Т2. Значения масс исследуемых тел и
калориметрического стакана возьмите у преподавателя или у лаборанта. Таблица 1.
7. За нитку вытащите тело из
кипящей воды, быстро опустите его в калориметр (5) с холодной водой и
закройте крышкой (6). 8.
Поместите в калориметр термометр и следите за ростом температуры.
Запишите в таблицу максимальное значение температуры Т0 всей системы «тело – вода – калориметрический
стакан». 9.
Меняя воду в калориметре, проведите измерения по п.п. 2–8 для трех
различных металлических тел, удельные теплоемкости которых приведены в
таблице 2. 10. По формуле (16) рассчитайте изменение энтропии системы для всех трех случаев и результаты
вычислений занесите в таблицу 1. Таблица 2.
4.
ВОПРОСЫ ДЛЯ ДОПУСКА К
РАБОТЕ 1. Сформулируйте цель
работы. 2. Опишите рабочую установку
и ход эксперимента. 3. Какие допущения делаете,
рассматривая систему «тело – вода - калориметрический
стакан» как изолированную? 4. Напишите рабочую формулу,
приведенную в данной работе. 5. Какие законы используются
для получения расчетной формулы? 6. Какие состояния и
процессы называются равновесными? 7. Что называется
изолированной термодинамической системой? 8. Напишите формулу для
вычисления абсолютной и относительной погрешности измерения DS. 5. ВОПРОСЫ ДЛЯ ЗАЩИТЫ
РАБОТЫ 1.
Сформулируйте первый закон термодинамики. 2.
Дайте определение обратимых и необратимых процессов. При каких
условиях процессы будут обратимыми? 3.
Сформулируйте второй закон термодинамики и поясните его физический
смысл. Чем он дополняет первый закон термодинамики? 4.
Опишите энтропию системы и ее физический смысл. 5.
Как вычисляется изменение энтропии при переходе ее из одного состояния
в другое? 6.
Сформулируйте и напишите второй закон термодинамики, используя понятие
энтропии. 7.
Статистический смысл энтропии. 8.
Какой знак имеет изменение энтропии для рассматриваемой в работе
системы тел и почему? 9.
Поясните принцип действия
тепловой машины. 10. В чем сущность
неравенства Клаузиуса? |