|
Лабораторная работа № 409 ИЗУЧЕНИЕ СПЕКТРА ИЗЛУЧЕНИЯ АТОМОВ ЦИНКА Цель работы: исследование спектра излучения паров цинка в видимой области спектра. Приборы и принадлежности: стилоскоп «Спектр», градуировочная кривая стилоскопа, образец цинка или цинкосодержащего вещества. 1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ Для задания состояния электрона в атоме необходимы четыре квантовых числа. 1. Главное квантовое число n в основном определяет энергию электрона En и принимает значения n = 1, 2, 3,… 2. Азимутальное (орбитальное) квантовое
число 3. Магнитное
квантовое число m 4. Магнитное
спиновое квантовое число ms определяет
проекцию собственного импульса электрона (спина) на физически выделенное
направление квантования z;
Состояния
электрона в атоме, соответствующие различным значениям момента импульса,
принято обозначать строчными буквами в соответствии со значением числа Распределение электронов по квантовым состояниям в невозбужденных атомах устанавливается принципом наименьшей энергии, согласно которому электроны должны располагаться на самых низких, доступных для них, энергетических уровнях, и принципом Паули, запрещающим одновременное сосуществование в атоме двух электронов, имеющих одинаковый набор всех четырех квантовых чисел (то есть находящихся в одном и том же квантовом состоянии). По этой причине в состояниях с данным квантовым числом n в атоме могут находиться не более 2n2 электронов. Совокупность
электронов, имеющих одинаковые значения квантового числа n, образуют
оболочку, а совокупность электронов оболочки с одинаковым значением
квантового числа Распределение
электронов в атоме по состояниям с различными значениями n и Таблица 1.
1.2.Оптические спектры атомов Оптические так же, как и химические свойства атома определяются числом его валентных электронов, поэтому спектры атомов с одним и тем же числом валентных электронов имеют много общего. Чем больше валентных электронов в атоме и чем больше порядковый номер элемента, тем более сложна структура спектра. В атоме
водорода имеется лишь один электрон, находящийся в кулоновском поле ядра. Как
показано в квантовой механике, стационарные значения энергии его уровней
зависят лишь от главного квантового числа n. Следовательно, каждому
собственному значению энергии En (кроме E1) соответствует несколько квантовых состояний,
отличающихся значениями квантовых чисел Схему уровней энергии атома водорода можно изобразить, учитывая вырождение состояний (см. рис.1). Состояние, обозначенное на рисунке как 1s, называется основным состоянием атома водорода. В этом состоянии электрон обладает минимальной энергией. Для перевода атома в возбужденное состояние, то есть в состояние с бόльшей энергией, ему необходимо сообщить энергию. Переходы
электронов из одного стационарного энергетического состояния в другое,
сопровождающиеся излучением или поглощением света атомом, происходят в
соответствии с правилом отбора для азимутального квантового числа D То есть,
возможны только такие переходы, при которых Пользуясь условными обозначениями состояний электрона, переходы, разрешенные правилом отбора (на рис.1 показаны наклонными линиями), можно записать в виде np
nf
Атомы
щелочных металлов (Li, Na, K, Rb, Cs)
представляют собой систему, состоящую из ядра, электронов внутренних оболочек
и одного внешнего (валентного) электрона. Z-1
электронов внутренних оболочек и ядро образуют устойчивый «остов» (атомный
«остаток»). Такую систему рассматривают как «водородоподобную», где в поле
атомного остатка движется слабосвязанный электрон. Определение энергетических
уровней водородоподобных систем с учетом возмущения, вызванного атомным
остатком, показывает, что значения энергии зависят не только от главного квантового
числа n, но и от орбитального квантового
числа
Стационарные
значения энергии, соответствующие состояниям электрона с одинаковым квантовым
числом n, но различными значениями орбитального
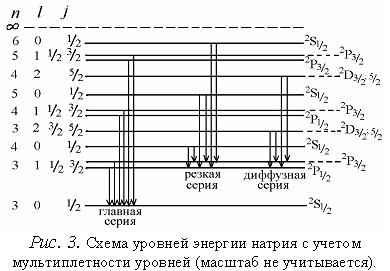
квантового числа На рис.2 показаны переходы в спектре атома натрия, разрешенные правилом отбора и образующие несколько спектральных серий. Кроме того, спектральные линии многоэлектронных атомов расщепляются на две или более компонент, называемых мультиплетами. Мультиплетная структура спектров объясняется существованием спина электрона. Валентный
электрон атома натрия, кроме орбитального момента импульса M где j –
квантовое число, принимающее значения Известно,
что с механическими моментами импульсов электронов связаны магнитные
дипольные моменты, которые взаимодействуют друг с другом подобно двум
контурам с током. Энергия такого взаимодействия зависит от «взаимной
ориентации» орбитального и спинового магнитных моментов. Следовательно, состояния
с различными числами j должны иметь различную энергию.
Квантовомеханическое решение задачи нахождения стационарных значений энергии
с учетом такого спин-орбитального взаимодействия действительно показывает,
что значения энергии зависят от трех квантовых чисел: n,
Оптические спектры атомов, у которых число валентных электронов отличается от единицы, имеют более сложный вид. Для многоэлектронных атомов полные орбитальные и спиновые моменты импульсов складываются из моментов импульсов отдельных электронов. При этом для заполненных электронами оболочек суммарный момент импульса равен нулю. Атом в целом характеризуется суммарными моментами импульсов электронов только незаполненных валентных оболочек. Орбитальные
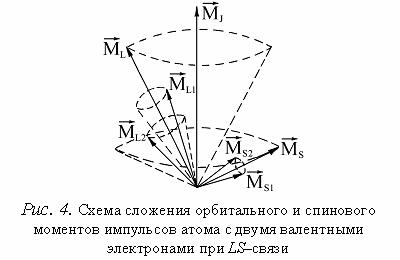
спиновые моменты валентных электронов складываются с соблюдением квантовомеханических
законов пространственного квантования, образуя суммарный вектор 1) сначала суммируются по отдельности орбитальные и спиновые моменты валентных электронов, а затем определяют суммарный момент импульса; 2) сначала суммируют орбитальный и спиновой моменты каждого электрона, а затем находят сумму по всем электронам.
На рис.4 представлена векторная схема сложения орбитального и спинового моментов импульса атома с двумя валентными электронами при LS–связи. Числовые значения результирующих моментов такого атома определяются выражениями:
Причем Состояния атома с различными значениями числа J соответствуют различным взаимным ориентациям орбитальных и спиновых моментов. Поэтому такие состояния характеризуются различной энергией. При заданных L и S число различных значений J равно 2S+1. Это означает, что уровень энергии атома с данными L и S при L>S расщепляется на 2S+1 подуровней. Число подуровней называют мультиплетностью. В системе из двух электронов S = 0 и S =1, следовательно, мультиплетность может быть равна 1 и 3, т.е. образуются одиночные (синглетные) уровни и триплетные уровни. Мультиплетность уровней энергии приводит к своеобразным закономерностям во взаимном расположении линий в спектре излучения атомов. На практике именно анализ спектров излучения позволил впервые получить сведения об относительном расположении энергетических уровней атомов и электронной структуре атомов, а также связать мультиплетную структуру энергетических уровней со своеобразным и существенным свойством электрона – спиновым моментом импульса. В работе анализируют спектр паров излучения цинка и схемы энергетических уровней атома цинка, ртути и кадмия. Атомы Zn, Hg и Cd в наружной электронной подоболочке имеют два электрона. Результирующие моменты импульсов ML и MS внутренних оболочек равны нулю. На рис.5 изображена схема энергетических
уровней атома ртути и возможные переходы между ними. В нормальном состоянии
оба наружных электрона являются 6s–электронами,
поскольку их главные квантовые числа n =
6, а орбитальные Энергетические
уровни (состояния) электрона в многоэлектронных атомах, ответственные за
спектральные линии, характеризуют числами – термами Таблица 2 Возможные состояния валентных электронов атома ртути
На рис.5 в вертикальном направлении отложена полная энергия системы электрон - одновалентный ион. За нулевое значение энергии этой системы принимают энергию, соответствующую полному отщеплению одного электрона от атома, поэтому энергия системы отрицательная. Числа 6, 7, 8, … соответствуют значениям главного квантового числа валентного электрона. Оболочки с квантовыми числами n = 1, 2, 3, 4, 5 занимают 78 внутренних электронов атома ртути. Эти электроны в образовании оптического спектра не участвуют.
Уровень
энергии, соответствующий нормальному состоянию атома ртути
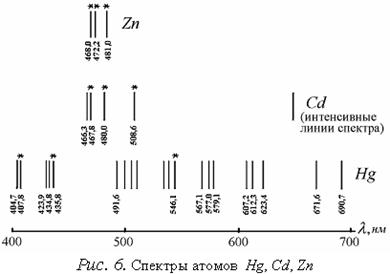
Спектры атомов цинка, кадмия и ртути сходны между собой (см. рис.6, линии триплета для Zn, Cd, Hg обозначены *).
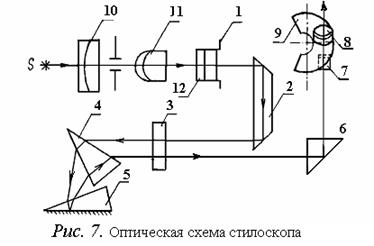
Зависимость энергии квантового числа J при данных L и S определяет значение триплетного расщепления: для больших атомных номеров расщепление имеет бόльшее значение. Если определить длины волн соответствующих спектральных линий, можно построить схему энергетических уровней атомов. В работе необходимо обнаружить и измерить длины волн спектральных линий триплета Zn. 2. ОПИСАНИЕ РАБОЧЕЙ УСТАНОВКИ И МЕТОДА Для разложения света, даваемого источником, в спектр и для его наблюдения пользуются разнообразными спектроскопами. В данной работе применяется спектроскоп специальной конструкции, называемой стилоскопом «Спектр». Стилоскоп «Спектр» с фотометрическим клином предназначается для быстрого визуального качественного и полуколичественного спектрального анализа сталей и цветных сплавов в видимой области спектра. Стилоскоп применяется для экспрессных анализов, к точности которых не предъявляется высоких требований. Продолжительность анализа одного образца по всем элементам 2-3 минуты. Прибор используется на складах при контроле материалов, на шихтовых дворах, в пунктах сортировки металлического лома и экспресс-лабораториях литейных цехов. Анализ на стилоскопе не сопровождается повреждением образца, это позволяет проверять готовые детали на сборке, в инструментальных и производственных цехах металлообрабатывающих заводов. Стилоскоп с фотометрическим клином при работе с цветными и черными сплавами дает возможность сортировать более близкие марки сплавов. Прибор находит также широкое применение в научно-исследовательских и учебных лабораториях. Оптическая схема прибора приведена на рис. 7. Свет от дуги S с помощью 3-х линзовой системы 10, 11, 12 равномерно заполняет щель 1. Отражательная призма 2 направляет пучок света в объектив 3, в фокусе которого помещена щель. Полученный параллельный пучок попадает на диспергирующие призмы 4 и 5. Большой катет призмы 5 с преломляющим углом 30° посеребрен. Поэтому лучи отражаются от него, проходя в обратном направлении через призмы 5, 4 и объектив 3, и попадают на прямоугольную призму 6 и зеркало 7, которые направляют их в окуляр 8. В фокальной плоскости окуляра расположен фотометрический клин 9. Оптика стилоскопа заключена в коробку.
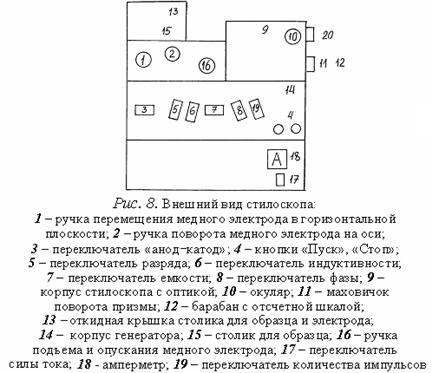
Внешний вид прибора схематически изображен на рис.8. Здесь: 9 - коробка стилоскопа с оптикой; 10 – окуляр; 11 – маховичок; 12 – барабан с равномерной шкалой и нанесенными возле нее символами химических элементов. Конструктивной особенностью стилоскопа является то, что при вращении маховичка 11 линии спектра перемещаются в поле зрения окуляра, что позволяет наблюдать последовательно те или иные участки спектра. Источником света служит электрическая дуга (или искра) между анализируемым (сменным) и постоянным дисковым электродом. Постоянный электрод монтируется внутри съемного столика 13 с вырезом, на верхнюю плоскость которого над вырезом устанавливается анализируемый образец-электрод. Дуга питается от генератора, смонтированного внутри литого корпуса 14. Питание от сети 220 В к генератору стилоскопа подается кабелем. На передних панелях стилоскопа и генератора находятся органы управления режимом работы генератора и ручки управления положением дискового электрода (обозначены в подписи к рис.8).
3.
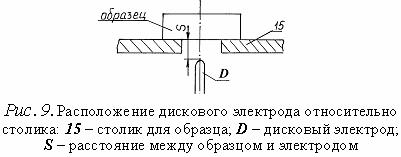
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ 1.Изучить описание стилоскопа «Спектр». 2.Расположить дисковый электрод D относительно поверхности столика 15 в соответствии с рис.9 (S = 2-3 мм). Расстояние S регулируется вращением маховичка 16 (см. рис.8). На столик 15 поместить образец цинка или цинкосодержащего вещества (например, латунь), расположив его над дисковым электродом.
3.Установить переключатели (рис.8) «перекл. тока» в положение «5А», переключатели «катод» и «анод» - в положение «выкл.», «комбинированный разряд» - в положение П, «индуктивность» - «0», «емкость» - «0», «фаза» - «60°», «количество импульсов» - «1». Включить генератор в сеть 220 В и нажать кнопку «пуск». Если дуга не зажигается, обратиться к преподавателю или лаборанту. 4.Белую точку, нанесенную на маховичок 20 (рис.8) установить против обозначения 20 шкалы. 5.Исследовать спектр цинка, вращая маховичок 11 (рис.8) и рассматривая линии цинка в окуляр стилоскопа. При этом необходимо учитывать, что наблюдаемый спектр представляет собой наложение двух спектров: спектра меди (от дискового электрода) и спектра цинка. Поэтому при определении искомых линий триплета цинка следует руководствоваться взаимным расположением линий, показанным на рис.6, и градуировочным графиком стилоскопа. Линии триплета следует искать в диапазоне 465 <l< 485 нм (голубые линии спектра). 6.Установить каждую найденную линию триплета против треугольного выреза визира. Записать числовые отсчеты по барабану. По градуировочному графику определить длины волн линий триплета. Данные занести в таблицу результатов (табл. 3), заполнив пустые места. Таблица 3.
7.Выключить стилоскоп (кнопка
«стоп»). 8.Определить расстояние между
энергетическими уровнями, ответственными за спектральные линии по формуле: DЕ = hn = hc/l, где h –
постоянная Планка; c -
скорость света; l,n -
длина волны и частота излучаемого света. Результат выразить в эВ. 9.Начертить для атома Hg (n = 6), Cd (n = 5) и Zn (n = 4)
фрагменты полной энергетической схемы, отображающие расположение уровней
энергии n 4. ВОПРОСЫ ДЛЯ ДОПУСКА К РАБОТЕ 1. Сформулируйте цель работы. 2. Опишите ход работы. 3. Опишите рабочую установку. 4. Поясните природу линейчатых спектров атомов. 5. Опишите порядок обработки результатов. 5. ВОПРОСЫ ДЛЯ ЗАЩИТЫ РАБОТЫ 1. Какие квантовые числа задают состояние электронов в атоме? Как они обозначаются? 2. Сформулируйте принцип Паули. 3. Объясните энергетическую диаграмму атома натрия и ее отличие от энергетической диаграммы атома водорода 4. Объясните причины расщепления уровней натрия на 2 подуровня. 5. Объясните причину мультиплетности уровней атомов Hg, Cd и Zn. 6. Как определить для многоэлектронных атомов полные орбитальный и полный спиновый моменты импульсов атома? Какую связь называют LS-связью? 7. Какими выражениями определяются значения результирующих моментов атома? 8. Объясните схему энергетических уровней атома ртути. 9. Дайте анализ фрагментов полной схемы энергетических уровней атомов ртути, кадмия и цинка. Список
рекомендуемой литературы 1. Савельев И.В. Курс общей физики. Кн.5. Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц. - М.: АСТ, 2001.- 368 с. 2. Алексеев Б.Ф. и др. Лабораторный практикум по физике./ Под ред. К.А. Барсукова, Ю.И. Уханова. – М.: Высш. шк., 1988. – 351 с. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||