|
Лабораторная
работа № 36 ЭЛЕКТРОПРОВОДНОСТЬ
ЖИДКОСТЕЙ. Цель работы - определение числа Фарадея и заряда электрона. Приборы и принадлежности: электролитическая ванна с раствором медного купороса, источник постоянного тока, секундомер. Прохождение
тока через электролиты Вещества, молекулы которых в растворе или в расплаве распадаются на ионы, называются электролитами. Такой процесс распада называется электролитической диссоциацией. К электролитам относятся водные растворы солей, кислот, щелочей, а также расплавленные соли. Электрический ток в электролитах обусловлен движением ионов под действием внешнего электрического поля. Поэтому проводимость электролитов, в отличие от электронной проводимости металлов, принято называть ионной. Прохождение постоянного тока через электролиты связано с переносом вещества и сопровождается выделением составных частей этих веществ на электродах. Это явление называется э л е к т р о л и з о м. Если ввести в электролит два электрода (металлических или угольных), соединенных с полюсами источника постоянного напряжения, и создать внешнее постоянное электрическое поле, то под действием электрических сил ионы в растворе придут в направленное движение. К аноду будут двигаться отрицательные ионы (анионы), к катоду - положительные (катионы). Достигнув
электродов, ионы разряжаются: анионы отдают аноду свои избыточные электроны,
катионы восстанавливаются на катоде. Например, молекулы медного купороса CuSO4 диссоциируют при растворении на положительные ионы Cu++ и отрицательные ионы Кроме ионов Cu++ и Ионы меди Cu++ разряжаются легче, чем ионы водорода H+, поэтому при прохождении тока на катоде будет происходить выделение меди:
Ионы Ионы
Иначе протекает процесс, если анод изготовлен из меди. В этом случае разряд ионов происходит только у катода. У анода же, наоборот, ионы металла переходят в раствор. Объяснить это
можно тем, что атомы меди Cu теряют электрон легче,
чем ионы Следовательно, электролиз CuSO4 при медном аноде сводится к переносу меди с анода на катод. В то же время количество медного купороса останется неизменным в растворе. Законы электролизаПусть заряд одного иона равен Ze, где е – элементарный заряд, Z – валентность иона, т.е. число электронов, отданных или приобретенных при диссоциации каждым атомом. Заряд, отдаваемый электроду равен q = n∙Z∙e, (1) где n –число ионов. C другой стороны, масса М выделившегося на электроде вещества равна М = n∙m, (2) где m – масса одного иона. Из формул (1) и (2) находим М= Известно, что в
одном моле ν любого вещества содержится одинаковое число атомов: N = NA, NА = 6,023· 10 Тогда масса иона (массами двух оторванных от атома электронов пренебрегаем) будет равен
m= где μ - молярная масса Подставим выражение (4) в (3), получим М = Величина
постоянная для каждого вещества, называется электрохимическим эквивалентом данного вещества. Таким образом, масса М выделившегося на электроде вещества пропорциональна величине заряда q, прошедшего через электролит (первый закон Фарадея). Величина заряда q, прошедшего через электролит, равна произведению силы тока I на время t его прохождения: q = I·t. Поэтому электрохимический эквивалент (с учетом (5) и (6)) может быть рассчитан по формуле К
= Из формулы (6) находим А=
Величина Из уравнения (8) следует, что химический эквивалент веществ пропорционален его электрохимическому эквиваленту (второй закон Фарадея): К = Постоянная величина F называется числом Фарадея. Выражение (7) можно переписать в виде М = Для того чтобы на электроде выделилось количество вещества, численно равное А, через электролит надо пропустить заряд q = F. Следовательно, число Фарадея F численно равно величине заряда, при прохождении которого через электролит на электроде выделяется масса вещества, численно равная А. Из выражений (8), (9) следует, что F = Заряд одновалентного иона равен заряду электрона по абсолютной величине. Поэтому заряд электрона может быть вычислен по формуле е = Ход
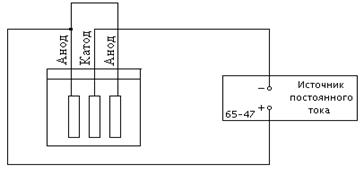
работы 1. Медный электрод, используемый в качестве катода, просушить на электроплитке в течение 10 минут и взвесить на лабораторных весах. Значение измеренной массы М1 занести в таблицу 1. 2. Поместить в стеклянную ванну с электролитом медные электроды – катод и анод. К отрицательной клемме источника постоянного тока подключить катод, к положительной – анод (см. рис. 1). Внимание! В предлагаемой лабораторной установке источник постоянного тока имеет возможность работать в режиме стабилизации тока, т.е. прибор автоматически поддерживает силу тока, заданную с помощью декадного переключателя тока, независимо от величины сопротивления нагрузки. О работе источника питания в режиме стабилизации тока свидетельствует свечение соответствующей лампочки. Если указанная лампочка не светится, следует с помощью декадного переключателя напряжения увеличить значение набранной величины напряжения до зажигания лампочки стабилизации тока. Ориентировочное значение набранной величины напряжения перед включением прибора равно 20 В. Значение величины тока задается руководителем работы. 3. Включить источник питания, одновременно пустить секундомер,
убедившись в работе источника питания в режиме стабилизации тока. Пропускать
ток через электролит 30-40 минут. 4. Выключить источник питания и секундомер, катод просушить на электроплите в течение 10 минут и с помощью весов определить его массу М2. Разность М1–М2 дает приращение массы катода М. Результаты измерений занести в таблицу. 5. По формулам (7), (11), (12) вычислить величины электрохимического эквивалента, числа Фарадея и заряда электрона. При расчетах следует принять, что для меди m =63,5×10-3 кг/моль и в соединении медь двухвалентна – Z = 2.
Результаты вычислений занести в таблицу. Таблица 1
Вопросы для допуска к работе1. Что называется электрохимическим эквивалентом? Что называется химическим эквивалентом? Каков их физический смысл? 2. Определите цель работы. 3. Опишите рабочую установку и запишите рабочие формулы. 4. Оцените погрешность данного метода измерений числа Фарадея и заряда электрона.
|